Физические и химические свойства этиленгликоля, формула
Содержание:
- Применение этанола
- Очистка и осушение
- Что такое этиленгликоль
- Что нужно знать об аммиаке
- Применение
- Этиленгликоль – токсичный двухатомный спирт
- История открытий и производства
- Что такое этиленгликоль
- Спирт и его виды
- Меры безопасности [ править | править код ]
- Первая помощь и выведение вещества из организма
- Виды и особенности
- Влияние концентрации водного раствора этиленгликоля на его теплофизические характеристики
Применение этанола
Богатый спектр воздействия винного спирта позволяет применять его в различных сферах. Самое широкое распространение он получил в следующих областях:
В качестве автомобильного топлива
Применение этанола как моторного топлива связано с именем американского промышленника Генри Форда. В 1880 году он изобрел первый автомобиль, работающий на этиловом спирте. Впоследствии это вещество начали применять для работы ракетных двигателей, разнообразных нагревательных приборов, грелок для туристов и военнослужащих.
Сейчас также активно используется бензин Е85 и Е95 на основе биоэтанола, что способствует уменьшению потребления нефтепродуктов, выброса парниковых газов и применения ископаемого топлива.
Таким образом, благодаря использованию автомобильного топлива с полным сгоранием (биоэтанол и его смеси) улучшается экологическая ситуация, поскольку воздух мегаполисов загрязняют преимущественно транспортные выхлопы.
В состав продуктов сгорания бензина входит огромное количество веществ, представляющих опасность для здоровья.
Фармакологическое производство
В этой отрасли этанол используется по-разному. Дезинфицирующие свойства медицинского спирта допускают его применение для обработки операционного поля, рук врача-хирурга. Благодаря использованию этанола удается уменьшить проявления лихорадки, изготавливать основы для настоек и компрессы.
Винный спирт принадлежит к противоядиям, помогающим при интоксикации этиленгликолем и метанолом. Он также применяется как пеногаситель при подаче кислорода либо искусственной вентиляции легких.

Химическая отрасль
Используя этанол, получают другие вещества, к примеру, этилен. Поскольку винный спирт является превосходным растворителем, он получил применение в производстве лакокрасочной продукции, средств бытовой химии.
Пищевая индустрия
Этанол служит основным компонентом алкогольных напитков. Он входит в состав продуктов, полученных посредством процессов брожения. Этиловый спирт применяют в качестве растворителя всевозможных ароматизаторов и консерванта при производстве хлебобулочных и кондитерских изделий. Он также служит пищевой добавкой Е1510.
Косметическая промышленность
Производители косметических и парфюмерных средств используют этанол для изготовления туалетной воды, духов, шампуней, одеколонов, спреев и другой продукции.
Иные направления
Этиловый спирт применяется для работы с препаратами, имеющими биологическую природу.
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Параметры эксплуатации этиленгликоля
Этиленгликоль заливают в алюминиевые бочки или в бочки из коррозионно-стойкой стали. По согласованию с потребителем этиленгликоль допускается заливать в стальные неоцинкованные бочки.
Этиленгликоль, упакованный в бочки, транспортируют в крытых транспортных средствах всеми видами транспорта, а так же наливом в ж/д цистернах (по согласованию с потребителем — в специально выделенных ж/д цистернах).
Этиленгликоль хранят в бочках в крытых неотапливаемых складских помещениях. Не допускается хранение продукта высшего сорта в бочках их углеродистой стали.
Родственные материалы этиленгликоля
Весьма близкими к этиленгликолю по свойствам являются диэтиленгликоль, триэтиленгликоль и глицерин, которые так же являются густыми прозрачными жидкостями, легко смешивающимися с водой, спиртом, ацетоном и некоторыми другими растворителями, причем глицерин является безвредным веществом. Диэтиленгликоль широко используется как растворитель смол, масел, нитроцеллюлозы и также в качестве основы антифризов.
Этиленгликоль, упакованный в бочки, транспортируют всеми видами транспорта в крытых транспортных средствах, а также наливом в железнодорожных цистернах. Этиленгликоль, упакованный в бочки, перевозят железнодорожным транспортом повагонно и мелкими отправками. При транспортировании наливом – в железнодорожных цистернах с котлами из алюминия или коррозионно-стойкой стали, по согласованию с потребителем – в железнодорожных цистернах с верхним сливом и цистернах из углеродистой стали.
Этиленгликоль хранят в герметичных емкостях из алюминия, коррозионно-стойкой стали или алюминированной стали.Этиленгликоль в бочках хранят в крытых неотапливаемых складских помещениях. Бочки с этиленгликолем должны храниться вертикально. Высота штабеля бочек не должна превышать три яруса.
Физико-химические показатели Этиленгликоля (Моноэтиленгликоля, МЭГ)
| # п/п |
Наименование показателя |
Норма | |
| Высший сорт ОКП 24 2212 0120 |
1-й сорт ОКП 24 2212 0130 |
||
| 1 | Массовая доля этиленгликоля, %, не менее | 99,8 | 98,5 |
| 2 | Массовая доля диэтиленгликоля, %, не более |
0,05 (0,10) |
1,0 |
| 3 | Цвет в единицах Хазена, не более в обычном состоянии после кипячения с соляной кислотой |
5 20 |
20 Не нормируется |
| 4 | Массовая доля остатка после прокаливания, %, не более | 0,001 | 0,002 |
| 5 | Массовая доля железа (Fе), %, не более | 0,00001 | 0,0005 |
| 6 | Массовая доля воды, %, не более | 0,1 | 0,5 |
| 7 | Массовая доля кислот в пересчете на уксусную, %, не более | 0,0006 (0,001) |
0,005 |
| 8 | Показатель преломления при 20оС | 1,431 — 1,432 | 1,430 — 1,432 |
| 9 | Пропускание в ультрафиолетовой области спектра, %, не менее, при длинах волн, нм: 220 275 350 |
75 |
Не нормируется То же То же |
Температура замерзания водного раствора зависит от массовой доли
следующим образом:
| Массовая доля этиленгликоля (%) в водном растворе | Температура замерзания, ° C |
| 10 | -4 |
| 15 | -5 |
| 20 | -9 |
| 25 | -12 |
| 30 | -14 |
| 40 | -22 |
| 50 | -35 |
| 60 | -49 |
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
Что нужно знать об аммиаке

В медицинской практике врачи используют еще один вид спирта. Вы догадались, что это нашатырный спирт. Вред для человека известен, к сожалению, не всем людям. Как правило, нашатырь используют для приведения человека в чувство после обморочного состояния. Достаточно несколько капелек нанести на ватный тампон и вдохнуть. Таким же веществом врачи-хирурги обрабатывают руки непосредственно перед проведением операции.
Полезные свойства:
- ускорение регенерации поврежденных тканей;
- расширение кровеносных сосудов;
- устранение спазмов и напряжения мышечных тканей;
- возбуждающее и антисептическое воздействие;
- ускорение отхождения мокроты;
- повышение уровня артериального давления.
Как правило, нашатырный спирт применяют наружно. Если человек находится в обморочном состоянии, ему необходимо вдохнуть пары раствора аммиака. В этом случае спирт оказывает раздражающее воздействие, стимулирует работу кровеносной системы, повышает артериальное давление. Еще использование нашатыря может спровоцировать рвотный рефлекс.

Используют нашатырный спирт в качестве бактерицидного средства. С его помощью можно избавиться от грибковых микроорганизмов и инфекционных возбудителей. Не только в альтернативной и традиционной медицине используется это химическое вещество. Широкое применение нашатырь нашел в быту и косметологической сфере.
При использовании нашатырного спирта следует соблюдать меры предосторожности, в противном случае такое лекарственное средство обратится в яд и причинит непоправимый вред человеческому организму. При попадании внутрь нашатыря в чистом виде следует спровоцировать рвоту и обратиться незамедлительно за квалифицированной врачебной помощью. На сегодняшний день существует множество разновидностей спиртов, которые используются в различных сферах нашей жизни
Огромной популярностью пользуется этиловый спирт, составляющий основу алкогольной продукции, лекарственных препаратов, косметики. Даже в пищевой промышленности используется этанол в качестве консерванта. Вот только нужно помнить, что спирт может и причинить непоправимый вред. Так, метанол – это чистейший яд, употребление которого приводит к летальному исходу. Будьте здоровы!
На сегодняшний день существует множество разновидностей спиртов, которые используются в различных сферах нашей жизни. Огромной популярностью пользуется этиловый спирт, составляющий основу алкогольной продукции, лекарственных препаратов, косметики. Даже в пищевой промышленности используется этанол в качестве консерванта. Вот только нужно помнить, что спирт может и причинить непоправимый вред. Так, метанол – это чистейший яд, употребление которого приводит к летальному исходу. Будьте здоровы!
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
-
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
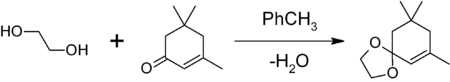
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА
1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной .
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Этиленгликоль – токсичный двухатомный спирт
Химическая формула данного простейшего многоатомного спирта – С2Н6О2 (иначе ее можно записать следующим образом – НО–СН2–СН2–ОН). Этиленгликоль имеет слегка сладковатый вкус, не имеет запаха, в очищенном состоянии выглядит, как немного маслянистая бесцветная прозрачная жидкость.
Так как он причислен к токсичным соединениям (по общепринятой классификации – третий класс опасности), следует избегать попадания данного вещества (в растворах и в чистом виде) в организм человека. Основные химические и физические свойства 1,2-диоксиэтана:
- молярная масса – 62,068 г/моль;
- коэффициент оптического преломления – 1,4318;
- температура воспламенения – 124 градуса (верхний предел) и 112 градусов (нижний предел);
- температура самовоспламенения – 380 °С;
- температура замерзания (стопроцентный гликоль) – 22 °С;
- температура кипения – 197,3 °С;
- плотность – 11,113 г/кубический сантиметр.
Пары описываемого двухатомного спирта вспыхивают в тот момент, когда его температура достигает 120 градусов. Еще раз напомним, что 1,2-этандиол имеет 3-й класс опасности. А это означает, что его предельно допустимые концентрации в атмосфере могут быть не более 5 миллиграмм/кубический метр. Если же этиленгликоль попадает в организм человека, в нем могут развиться необратимые негативные явления, которые способны привести к смерти. При однократном употреблении вовнутрь 100 и более миллилитров гликоля наступает летальный исход.
Пары данного соединения менее токсичны. Так как этиленгликоль характеризуется сравнительно малым показателем летучести, реальная опасность для человека возникает тогда, когда он систематически вдыхает пары 1,2-этандиола. О том, что есть вероятность отравления парами (либо туманами) рассматриваемого соединения, сигнализирует кашель и раздражение слизистой оболочки. Если человек отравляется гликолем, ему следует принять препарат, содержащий 4-метилпиразол (мощный антидот, подавляющий фермент алкогольдегидрогеназы), или этанол (одноатомный этиловый спирт).
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида.
Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ.
В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Что такое этиленгликоль
По определению этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2) — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель многоатомных спиртов. Если вещество очищено, то представляет собой прозрачную бесцветную жидкость маслянистой консистенции.
Изначально этиленгликоль использовался во времена Первой мировой войны в качестве глицерина. Однако со временем изменил свое направление. Его стали использовать в различных сферах химической промышленности.
Формула и класс вещества
Химическая формула гликоля — C2H6O2, рациональная — C2H4 (OH) 2, структурная — HO—CH2—CH2—OH . В основе молекулы лежит непредельный скелет этилена, который состоит из двух атомов карбона. На свободные валентные места присоединились две гидроксильные группы.
У этиленгликоля есть несколько названий, которые зачастую встречаются в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Молекула имеет подобие транс-конфигурации в размещении гидроксильных групп. Такое расположение соответствует самому удаленному расположению водородов, что дает максимальную устойчивость системы.
Как получают
Массовое получение 1.2-этандиола началось еще в тридцатые годы прошлого века. Сначала получали лишь одним методом, потом появились новые. Таким образом, гликоль можно получить несколькими способами, однако некоторые из них стали частью истории, а другие превзошли их качеством.
Изначально 1,2-диоксиэтан получали из дибромэтана. Двойная связь этилена разрывается, а свободные валентности занимаются галогенами — исходным веществом в данной реакции. Образование промежуточного соединения возможно благодаря замещению ацетатными группами, которые при гидролизе превращаются в спиртовые.
С улучшением технологий появился новый метод — получение этиленгликоля прямым гидролизом любых этанов и этиленов , которые замещены двумя галогенами соседних атомов карбона. С помощью различных водных растворов, карбонатов металлов, воды и диоксида свинца начинается реакция, которая возможна лишь при больших температурах и давлении. Побочные вещества — диэтиленгликоль и триэтиленгликоль.
Следующий способ позволил получать 1,2-диоксиэтан из эфира этиленхлоргидрина путем его гидролиза угольными солями. При 170 градусах выход целевого продукта достигал 90 %. Однако был значительный недостаток — гликоль необходимо извлекать из раствора соли. Ученые решили эту проблему. Они разбили процесс на две стадии, при этом оставив то же исходное вещество.
Гидролиз этиленгликоль ацетатов стал отдельным способом, когда получилось добыть исходный реагент путем окисления этилена в уксусной кислоте кислородом.
Спирт и его виды
Именно английское «Spirit» лежит в основании русского названия «спирт». Это вещество представляет собой органический продукт (производное углеводов), в химической формуле которого содержится гидроксильная группа. Существуют разные классификации спиртов. Согласно одной из них различают одноатомные, двухатомные и многоатомные вещества. Также химики группируют их на ненасыщенные, насыщенные и ароматические. Еще одна классификация предусматривает разделение спиртов на первичные и вторичные. Простой спирт – это жидкость без цвета, но с характерным запахом и вкусом, легко растворяемая водой в любых пропорциях. И чем больше атомов в спиртах, тем легче они соединяются с водой. А вот для маслянистых и жиросодержащих веществ спирт и сам служит растворителем.
В природе это вещество содержится, как правило, в составе эфирных масел. В листьях многих растений содержится метиловый спирт. После брожения органических продуктов образуется этиловый спирт. Кстати, к этой категории веществ относят также и некоторые витамины, например, А, D, В8.
Химики определяют спирт, как вещество, полученное в результате гидрогенизации окиси углерода под воздействием катализаторов. Чаще всего в разных сферах жизнедеятельности используют такие спирты:
Меры безопасности [ править | править код ]
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен . По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела) . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол .
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой .
- Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
- Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
Получение многоатомных спиртов
I . Получение двухатомных спиртов
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:
II . Получение трёхатомных спиртов (глицерина)
Омыление жиров (триглицеридов):
Химические свойства многоатомных спиртов
1. С активными металлами:
2. С гидроксидом меди( II ) – качественная реакция!
1. С галогенводородными кислотами
Т ринитроглицерин — основа динамита
- Этиленгликольпроизводства лавсана, пластмасс, и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в органическом синтезе.
- Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканейи в других областях народного хозяйства. Сорбит(шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Первая помощь и выведение вещества из организма
Алгоритм действий по оказанию помощи человеку, выпившему этиленгликоль или жидкость, его содержащую, таков:
- Вызвать бригаду скорой помощи;
- Промыть желудок содовым раствором (1 столовая ложка на 0,5 л воды);
- Давать обильное теплое питье: молоко, минеральная вода без газа;
- Дать выпить сорбент (активированный уголь, полисорб, энтеросгель);
- Дать слабительное, лучше всего подойдет магнезия.
Если пострадавший в сознании, и его состояние не тяжелое, хорошо дать выпить 100 мл водки или 50 мл медицинского спирта, разбавленного пополам с водой. Как это ни покажется странным, этиловый спирт является антидотом этого токсичного вещества, который можно применить в домашних условиях.
Если пострадавший без сознания, его нужно уложить на ровную поверхность, повернув голову набок во избежание асфиксии содержимым желудка в случае рвоты. Необходимо прощупать пульс и измерить давление. Пульс может быть нитевидным и даже не прощупываться на запястье, определять его нужно на сонных артериях – боковой поверхности шеи.
В стационаре в качестве антидота при отравлении этиленгликолем вводится внутривенно стерильный щелочной раствор – бикарбонат натрия (сода), вводится глюконат кальция для восполнения его потери. Проводится восстановительная терапия, в зависимости от степени возникших нарушений. При тяжелом отравлении для очистки крови подключают аппарат гемосорбции (искусственная почка).
Виды и особенности
Для обогрева загородных домов и дач устраивается автономная система отопления. Она состоит из нагревательного котла, соединённого с радиаторами отопления разветвлённой системой трубопроводов. Заливаемая в них незамерзающая жидкость выполняет роль теплоносителя. После нагревания в котле она поступает по трубам к радиаторам.
Незамерзающую жидкость принято называть антифризами. Их химический состав не позволяет им замерзать даже в самые сильные морозы. Антифризы предотвращают появление коррозии на внутренней поверхности труб и радиаторов и не образует на ней накипи. Выбор вида теплоносителя для заливки в отопительную систему от различных факторов, в числе которых климатические условия региона его использования.
Помимо антифриза, выполняющего роль теплоносителя, правила эксплуатации отопительной системы требуют её периодической промывки специальными жидкостями. Их состав содержит различные присадки.
Альтернативным вариантом таким промывочным жидкостям может служить водный раствор каустической соды. Заполняют им систему на 1-1,5 часа. Делают это для растворения содовым раствором скопившейся на внутренних поверхностях элементов отопительной системы накипи.
В продаже можно встретить антифризы с различными характеристиками. В качестве их основы могут использоваться:
Глицерин
Этиленгликоль
Пропиленгликоль
Все эти вещества имеют высокую степень агрессивности, поэтому производители добавляют в их состав различные присадки. Основной компонент антифриза определяет его свойства. Самую доступную стоимость имеют незамерзающие жидкости на основе этиленгликоля, но они и наиболее токсичные.
Незамерзающие жидкости на основе этиленгликоля нельзя применять для двухконтурных котлов. Попадание такого антифриза в систему водоснабжения может вызвать тяжёлое отравление. Жидкость закипает при температуре выше 110°С и может дать осадок. Он часто становится причиной выхода системы отопления из строя.
Менее опасны и вредны для организма человека антифризы на основе пропиленгликоля. Экологически безопасны незамерзающие жидкости, изготовленные на основе глицерина.
Антифризы этого вида хорошо защищают систему отопления от коррозии. Особенностью глицериновых незамерзающих жидкостей является то, что при переходе в твёрдое состояние они не увеличиваются в объёме.
Самая низкая температура замерзания и наиболее высокая точка кипения, а также теплопередающая способность у раствора бишофита. Очень часто в системы отопления в качестве теплоносителя используют растворы кальция, натрия и других минеральных солей. Их достоинством считается высокая коррозийная агрессивность.
Влияние концентрации водного раствора этиленгликоля на его теплофизические характеристики
|
|
| Упаковка:от 0,5 литров, тара любая- канистры п/э 1л, 5л, 10л,20л, 25л, 31,5л, 50л; бочки металлические 200л. |
В системах промышленного кондиционирования, на фармацевтических производствах и в пищевой промышленности необходимо поддерживать в помещениях определенную температуру. Эта задача решается с использованием незамерзающих жидкостей, включая теплоносители, антифризы. В последние годы широкое применение нашли водные растворы пропиленгликоля и этиленгликоля.
Ниже подробно рассмотрены теплофизические качества водного раствора этиленгликоля. Это вещество характеризуется:
— повышенной на 8-9% в сравнении с водой плотностью раствора, причем плотность возрастает по мере увеличения концентрации этиленгликоля; — повышенной в два-три раза в сравнении с водой динамической и кинематической вязкостью в зоне положительных температур, причем они возрастают в восемь-десять раз при увеличении концентрации до предельных 65% и уменьшении температуры кристаллизации до -65°C;- уменьшением в пределах до 20% в сравнении с водой теплопроводности и теплоемкости с увеличением концентрации этиленгликоля и понижением рабочей температуры в отрицательной зоне.
Из-за повышенной вязкости водного раствора этиленгликоля в зоне минусовых рабочих температур существенно увеличиваются гидравлические потери на трение в трубопроводах, а также на преодоление гидравлических сопротивлений в узлах промышленного кондиционирования и системы охлаждения (см. Таблица №1, 2, 3).
При существенном снижении (до 18%) теплопроводности и теплоемкости раствора этиленгликоля необходимо увеличение скорости циркулирования тепло-хладоносителя в системе или применение иных технических решений, обеспечивающих прием (передачу) требуемой тепловой энергии (мощности).
Совокупность всех этих факторов ведет к возникновению исключительных условий (ситуаций) при использовании инженерных систем в разном климате. Они должны учитываться при проектировании и использовании систем промышленного кондиционирования и отопления.